Las enfermedades de la unión neuromuscular, como su nombre indica, son las que aparecen por alteraciones a nivel de la sinapsis entre el músculo y el nervio periférico.
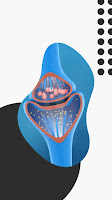
La unión neuromuscular es una estructura celular especializada para el contacto entre el axón de una neurona motora y la membrana de una fibra muscular. Las neuronas motoras transmiten el impulso nervioso, desde su cuerpo celular (o soma) hasta su membrana presináptica, viajando a lo largo de todo el axón y llegando al extremo en el que se liberan vesículas repletas de un neurotransmisor llamado acetilcolina (Ach) que, una vez liberado fuera de la neurona, se une a los receptores de la membrana postsináptica de la fibra muscular. Esta membrana postsináptica es eléctricamente excitable por la unión del neurotransmisor a los receptores, lo que permite que el impulso nervioso de la neurona motora se transmita desde el extremo del axón hacia la fibra muscular. La acetilcolina es hidrolizada por una enzima llamada acetilcolinesterasa, lo que limita su tiempo de estímulo sobre el receptor.El bloqueo neuromuscular puede ocurrir a varios niveles:
- Presináptico (síntesis y liberación de acetilcolina)
- Postsináptico (disminución o alteración funcional del receptor de acetilcolina)
- Alteración en la acción de la acetilcolinesterasa (por fármacos o tóxicos)
Para distinguir uno de otro es necesaria la realización de estudios de Electromiografía y Neuroconducción, que nos indicarán de cuál se trata.
Las consecuencias de este mal funcionamiento o bloqueo a nivel de la unión neuromuscular son: la fatiga muscular, debilidad y/o parálisis, asociado a algo muy característico que es su fluctuación, lo que hace que típicamente estos pacientes presenten diferentes grados de debilidad en el transcurso del día, empeorando por lo general con el ejercicio físico, esfuerzo o calor y mejorando con el reposo y temperaturas más frías.
Las causas pueden ser muchas, pero habitualmente se deben a fenómenos inmunitarios contra los diferentes componentes de la unión neuromuscular, aunque también puede deberse a tóxicos, trastornos bioquímicos, congénitos, etc.
Dentro de las enfermedades de la unión neuromuscular encontramos el síndrome de Eaton Lambert, el botulismo, los síndromes miasténicos congénitos, la miastenia autoinmune iatrogénica, los síndromes de unión neuromuscular por tóxicos como organofosforados y toxinas venenosas de serpientes (E. Elapidae, E. Hidrophiodae) y artrópodos (Viuda Negra) pero es, sin lugar a dudas, la Miastenia Gravis la más frecuente y representativa de ellas.
Miastenia Gravis:
Es el trastorno primario de la transmisión
neuromuscular más frecuente, de causa autoinmune. Se caracteriza por una
debilidad muscular fluctuante afectando especialmente los músculos faciales, perioculares
y de la cintura de miembros.
Tiene una incidencia de 20 casos por cada 100 000 habitantes y una prevalencia de 142 enfermos por millón de habitantes. Es 2 veces más frecuente en mujeres que en hombres. Puede comenzar a cualquier edad en ambos sexos, aunque tiene una presentación bimodal con un primer pico entre los 15-35 años y predominio en mujeres y un segundo pico en varones mayores de 60 años. A las mujeres se les aconseja retrasar el embarazo hasta transcurridos 2 años después del diagnóstico.
¿Pero cómo y por qué ocurre?
En la Miastenia Gravis la membrana muscular postsináptica está deteriorada y simplificada, con pérdida de sus pliegues normales. También la concentración de receptores de acetilcolina (AchR) en la membrana de la placa terminal muscular está reducida y los anticuerpos y el complemento están unidos a la membrana, existe además un aumento de la hendidura sináptica. Todo esto hace que, a pesar de que se liberen cantidades normales de acetilcolina, su efecto en la membrana postsináptica está reducido pues al ser menos sensible al contacto con la Ach, la probabilidad de que se desencadene un potencial de acción muscular está muy reducida. (O sea que la enfermedad se caracteriza por una reducción notable del número de receptores de AchR sobre la membrana postsináptica de la unión neuromuscular). La reducción de receptores de acetilcolina, así como la destrucción de los pliegues postsinápticos es causada por anticuerpos contra el receptor que también bloquean la unión de la acetilcolina con el AchR, alterando así la transmisión neuromuscular, aunque es importante señalar que el origen de la reacción autoinmunitaria no se ha establecido aún. El 10% al 15% que son “seronegativos” para los anticuerpos anti-AchR suelen tener anticuerpos contra otra proteína de la unión neuromuscular, el receptor de la tirosinquinasa específico del músculo (MuSK). Los anticuerpos anti-MuSK y LRP -4 reducen el número de AchR funcionales. Estos pacientes tienen una forma particularmente generalizada de Miastenia Gravis y con peor pronóstico.
Puesto que la mayoría de los pctes con Miastenia gravis tiene anomalías tímicas y una reacción saludable a la Timectomía pues es posible implicar al timo en la patología de la enfermedad. Se ha encontrado que las células T y B del timo muestran una reacción particular al receptor de Ach, también contiene células mioides con receptores de Ach en su superficie.
Las anormalidades del timo están claramente asociadas con la Miastenia gravis, pero la naturaleza de la asociación es incierta. El 10% de los pacientes con la enfermedad tienen un tumor tímico y el 70% cambios hiperplásicos. Debido a que el timo es el órgano central para la auto tolerancia inmunológica, se sospecha que las alteraciones del timo causan una ruptura en la tolerancia, que desencadena un ataque inmunomediado sobre los AchR. El timo contiene todos los elementos necesarios para la patogénesis; células mioides que expresan el antígeno del AchR, células con antígenos presentes y células T inmunocompetentes. Se desconoce si el rol del timo en la patogénesis de la Miastenia gravias es primario o secundario. Los pacientes con timoma usualmente tienen una expresión grave de la enfermedad, con altos niveles de anticuerpos contra AchR y anormalidades en el EMG más severas. El 20 % cuyos síntomas comienzan en las edades de 30-60 años tienen timoma, y la frecuencia de timoma es menor cuando la enfermedad empieza después de los 60 años, pudiéndose observar rebeldía al tratamiento farmacológico.
Se puede catalogar como autoinmune porque tiene halotipos HLA como otras enfermedades autoinmunes y la sintomatología clínica mejora con la extracción del timo y también el tratamiento inmunosupresor, incluyendo la plasmaféresis, produce mejoría en la mayoría de los pacientes.
Entre sus principales manifestaciones clínicas se encuentra que se caracteriza por una
debilidad muscular fluctuante que empeora con la actividad física y mejora con
el reposo. (La actividad repetida de un grupo muscular agota su fuerza
contráctil y le conduce a una paresia progresiva que se recupera o mejora con
el reposo).
Son más vulnerables los músculos de los párpados, extraoculares, con menor frecuencia luego los de la cara, masticación, faringe y cuello, aunque también, en ocasiones, las molestias iniciales son en las extremidades. De manera que 2/3 de los pctes presentan como síntomas iniciales diplopía (visión doble) y ptosis palpebral; otros presentan inicialmente una disfagia (dificultad para deglutir), masticar o hablar (con disartria y/o voz nasal) y en muy pocos casos se presenta debilidad inicial en un grupo muscular limitado: cuello, extremidades o cintura de miembros). En los pctes miasténicos la sonrisa natural se transforma en un gesto, con un aspecto triste o somnoliento. La mandíbula puede quedar abierta, de manera que debe impulsarse hacia arriba con la mano, la masticación se dificulta con incapacidad para triturar y deglutir por lo que deja de comer. Les es más difícil comer después de hablar y cuando lo hacen de manera sostenida la voz se vuelve tenue y nasal como ya habíamos comentado. Las mujeres suelen quejarse de imposibilidad para peinarse por debilidad en los hombros, en otras ocasiones puede dificultarse sostener la cabeza por debilidad de los músculos del cuello, y puede ser difícil retener gases rectales por la debilidad del esfínter externo.
La debilidad fluctúa
con el día, generalmente es menor en la mañana y empeora al progresar el día,
especialmente después del uso prolongado de los músculos afectados. Ej. Los
síntomas oculares empeoran cuando el pcte está leyendo, viendo TV, conduciendo,
etc., La diplopía se debe a debilidad asimétrica de los músculos extraoculares.
En muchos casos avanzados todos los músculos se encuentran afectados, incluso el diafragma, los del abdomen y los intercostales y también pueden afectarse los esfínteres vesical y anal.
Los músculos debilitados solo se atrofian mínimamente o no lo hacen. Rara vez se alteran los reflejos.
Pasados 15 a 20 años, si el pcte no lleva tratamiento la debilidad se convierte en permanente y la mayoría de los músculos afectados se atrofian. Es lo que se conoce como Estado de consunción.
Mientras la enfermedad avanza, muestra diseminación insidiosa a partir de los músculos craneales hacia los de las extremidades y tronco. El curso es variable, aunque progresivo. La debilidad queda limitada a los músculos oculares en un 10 % de los pctes, aunque se ha registado que hasta un 40% no presentan progresión, y el 50% experimenta debilidad progresiva los primeros 2 años. Un 1/3 de los pctes tiene mejoría espontánea, 1/3 tiene enfermedad progresiva y 1/3 muere a causa de la misma. Los períodos de mejoría espontánea se presentan al inicio, pero raras veces son permanentes. También es posible que los síntomas se presenten por primera vez en el embarazo o más frecuente en el puerperio.
Existen factores que
empeoran los síntomas y signos miasténicos: trastornos emocionales,
enfermedades sistémicas (especialmente las respiratorias virales), hipo o
hipertiroidismo, embarazo, ciclo menstrual, fiebre y fármacos como: Benzodiazepinas
y otros ansiolíticos relacionados (zolpidem, etc.); Analgésicos opiáceos:
morfina, buprenororfina; Anticolinérgicos; Antiespasmódicos: atropina,
escopolamina y derivados. Agentes para incontinencia urinaria: tolterodina,
solifenacina, oxibutinina. Antidepresivos tricíclicos: imipramina,
clomipramina. Anti-parkinsonianos. Broncodilatadores: tiotropio, ipratropio. Cloroquina
e hidroxicloroquina. Colistina y otros antibióticos polipeptídicos. Sales de
magnesio (en dosis elevadas o uso IV); Telitromicina (y otros antibióticos
macrólidos); Toxina botulínica; Beta-bloqueantes (timolol, etc.) en uso
sistémico; Fenotiazinas (clorpromazina, etc.). Antibióticos aminoglucósidos
(gentamicina, etc.). Antibióticos flouroquinolónicos: ciprofloxacino; Miorrelajantes
de acción central (pancuronio).
Al examen neurológico podremos encontrar:
-Debilidad asimétrica de varios músculos, usualmente en ambos ojos (más severa en recto interno). Ptosis usualmente asimétrica que varía con la actividad sostenida. Pacientes con debilidad de los músculos oculares usualmente tienen dificultad para cerrar los ojos, la ptosis cambia de un ojo a otro, la elevación pasiva del párpado ptósico puede provocar caída del opuesto, la aplicación de edofronio y frío mejora la ptosis.
-Voz nasal sobre todo posterior a una
conversación prolongada. Puede haber ronquera por debilidad de los músculos de
la laringe.
-Expulsión de líquidos por la nariz cuando
traga por debilidad en la elevación del velo del paladar.
-Los que
presentan una forma grave o crónica tienen una facie característica llamada miasténica con los ángulos de la boca están descendidos que le dan apariencia de estar deprimido o triste, cuando intentan sonreír le dan un aspecto de cinismo.
La fuerza muscular se debe evaluar repetidamente durante el esfuerzo máximo y después de breves descansos.
Existe dos clasificaciones que nos permiten conocer que grado de afectación tiene el paciente para definir el mejor tratamiento y pronóstico. Nos referiremos a la que consideramos más práctica y sencilla que es la de Osserman.
Clasificación de Osserman:
A. Miastenia Gravis
Infantil.
B. Miastenia Gravis del
adulto.
Tipo I. Ocular
Tipo IIa. Generalizada ligera.
Tipo IIb. Generalizada Moderada - Grave.
Tipo III. Fulminante aguda.
Tipo IV. Crónica severa o severa
tardía.
Tipo V. Con atrofias musculares.
Detallaremos cada una de ellas:
- La Miastenia ocular hace referencia a la que es exclusivamente restringida a la musculatura extrínseca de los ojos y párpados, que aunque responde mal al tratamiento tiene un buen pronóstico.
- La Miastenia generalizada ligera: afecta a los músculos del tronco y de las extremidades, suele tener afectación ocular, con buena respuesta al tratamiento médico y quirúrgico y relativamente buen pronóstico.
- La Miastenia generalizada modera - grave: afecta a los músculos bulbares. Puede haber afectación ocular y generalizada. Puede haber “crisis miasténica” por trastorno de la deglución y neumonía por aspiración. Suelen tener buena respuesta, aunque lenta, al tratamiento médico-quirúrgico y un pronóstico regular.
- La Miastenia gravis fulminante aguda: afectación general, bulbar, y de los músculos respiratorios, de inicio brusco y rápido, tienen crisis miasténicas frecuentes, respuesta médica inconstante y quirúrgica buena, pero el pronóstico es malo.
- La Miastenia gravis tardía: afectación general, bulbar y de los músculos respiratorios. De larga evolución, con clínica poco importante y que se complica bruscamente con afectación respiratoria, crisis miasténicas frecuentes, tiene una respuesta médico-quirúrgica pobre y muy mal pronóstico.
El peligro de muerte por Miastenia Gravis
Generalizada es máximo durante el primer año; existe un segundo período de peligro
en los casos progresivos que comprende los 4 a 7 años después del inicio y
luego tiende a estabilizarse y el riesgo de recaídas graves disminuye. La
muerte se relaciona sobre todo con las complicaciones respiratorias.
Entonces surge una nueva interrogante: a qué nos referimos con crisis miasténica. Esta es no es más que la insuficiencia respiratoria aguda que se produce por debilidad miasténica que compromete los músculos de la respiración. También puede llevar a la cuadriparesia en cuestión de horas. Se suele desencadenar por infecciones, especialmente respiratorias. No es raro observar cierta resistencia a los anticolinesterásicos en la crisis miasténica, por lo que su supresión, aunque parezca paradójico, es conveniente. Todo paciente miasténico en crisis aguda debe ingresar inmediatamente en una UCI para aspirar secreciones, intubarlo y ponerlo bajo ventilación artificial si es preciso y tratar la causa. Con frecuencia es necesario aumentar la dosis de corticoides, la plasmaféresis o la administración de Intacglobín. Los anticolinesterásicos se reintroducen pasados unos días y lentamente según la respuesta individual.
A veces resulta difícil llegar rápido al diagnóstico cuando los síntomas son iniciales y leves. Es por ello que el diagnóstico positivo se realiza a través, no solo del examen físico sin de test diagnósticos como:
A). Test de Tensilón (cloruro de edofronio)
Es más confiable cuando el paciente tiene
ptosis palpebral, limitación discernible de los movimientos oculares o lenguaje
nasal. Positivo en más del 90% de los pacientes. La mejoría de la fuerza
muscular no es única de la MG (enfermedad de la neurona motora, lesiones de
nervios oculomotores). Dosis: 2 mg EV y evaluar respuesta dentro de 60
segundos. Pueden usarse 3 y 5 mg EV. Si con alguna de las dosis se produce
mejoría en 60 seg., no se debe usar una dosis superior. Los efectos clínicos de
mejoría no persisten por más de 5 mints.
B). Test de Neostigmina (Metilsulfato de
Neostigmina): se inyecta por vía intramuscular 1,5mg. Posterior a 10 o 15 mints
se comienzan a observar cambios objetivos que alcanzan su máximo a los 20 o 30
mints, y duran hasta 1 hora, que permite una verificación detalla de la mejoría
neurológica.
No obstante, existe un número pequeño de pacientes
que, aún con síntomas oculares aislados y que con el tiempo se les diagnostica
la enfermedad, pueden presentar el test de edofronio y de Neostigmina, así como
estudios electrofisiológicos y cuantificación de anticuerpos anti- AchR
completamente normales, durante el 1er cuadro o incluso varios episodios. Solo
más adelante, por razones no conocidas, los estudios resultan positivos.
C). Dosificación en sangre de anticuerpos
contra el receptor de la acetilcolina (AchR): los anticuerpos séricos se
identifican en 80 a 90 % de los casos con Miastenia Gravis Generalizada y
alrededor del 60% de los pctes con la MG con manifestaciones oculares.
Anticuerpo contra el receptor de la
tirosincinasa específica del músculo (MuSK): Los pacientes con presencia de
anticuerpos anti- MuSK desarrollan generalmente una debilidad oculobulbar
notable, a menudo con enfermedad grave y crisis respiratoria. Se presenta en un
pequeño por ciento de los pctes que son seronegativos. También
se han descrito casos con anticuerpos anti-LRP4 en un porcentaje de pacientes seronegativos
de entre 3 al 9% según autores.
También se puede realizar una dosificación de anticuerpos
antimúsculo estriado (tiene mayor incidencia en los pctes con timoma) y anticuerpos
anti-idiotipos.
D). Electromiografía:
Test de estimulación repetitiva:
Hay
que considerar al realizar la prueba: la temperatura del miembro que se va a
estudiar debe ser mayor de 34°C y el paciente debe abstenerse de tomar
inhibidores de la colinesterasa 12 horas antes del estudio. Se aplican de
cuatro a seis estímulos a una frecuencia de 2 Hz, antes y después de 30
segundos de ejercicio. Se repiten estos estímulos en intervalos de 1 minuto
hasta 5 minutos después de finalizado el ejercicio. La prueba se considera
positiva cuando existe una diferencia de amplitud de más del 10% entre el primer
y quinto potencial evocado. No es específica de la Miastenia gravis, pues puede ser positiva en otras
enfermedades neuromusculares.
La
amplitud del CMAP (Potenciales de acción compuesta musculares) desencadenada por
estimulación repetitiva de un nervio periférico, a razón de 3 estímulos por
segundo, puede ser normal o ligeramente reducida en la Miastenia gravis, pero lo
característico en ella es una transmisión neuromuscular alterada que se
demuestra cuando la amplitud de la 4ta o 5ta respuesta a un tren de baja
frecuencia de estimulación del nervio cae al menos un 10% del valor inicial.
Electromiografía de Fibra Única:
Es un método más sensible para identificar el
defecto de la transmisión neuromuscular y demuestra un ¨Jitter¨ incrementado en
algunos músculos en casi todos los pacientes con la enfermedad. Esta técnica demuestra la
variabilidad del intervalo de descarga de las fibras musculares que se conectan
a la misma unidad motora, que de ordinario es constante (Jitter), o el bloqueo
completo de descargas sucesivas de fibras musculares independientes que
pertenecen a la misma unidad motora. El Jitter es mayor en los músculos
débiles, pero puede ser anormal aún en los músculos normales con fuerza normal.
Los pacientes debilidad muscular ligera o debilidad puramente ocular pueden tener un Jitter
incrementado solamente en los músculos faciales. Un Jitter incrementado es un
signo no específico de anormalidad en la transmisión neuromuscular.
Si existe un Jitter aumentado se debe realizar
EMG para excluir neuronopatía, neuropatía o miopatía. Como habíamos comentado, un Jitter aumentado no es
un signo específico de transmisión neuromuscular anormal y puede aparecer en
otras enfermedades de las unidades motoras, sin embargo, un Jitter normal en un músculo
débil excluye una anormalidad en la transmisión neuromuscular como causa de la
debilidad.
Existen pocos ensayos clínicos controlados con respecto a los tratamientos médicos o quirúrgicos en la Miastenia gravis. Todos los regímenes recomendados son empíricos y los expertos tienen discrepancias con relación al tratamiento de elección.
Lo que es cierto y recomendable es que debe individualizarse, teniendo en cuenta la edad, severidad,
sexo, grado de afectación funcional y otras enfermedades asociadas.
El tratamiento de los pacientes con Miastenia Gravis incluye tres aspectos terapéuticos diferentes:
a) Tratamiento sintomático (con uso de anticolinesterásicos)
b) Tratamiento inmunológico (que incluye Timectomía, y uso de inmunosupresores)
c) Tratamiento inmunomodulador (Plasmaféresis y/o Inmunoglobulinas EV) en situaciones graves y
transitorias.
· Inhibidores de la
Acetil-colinesterasa o anticolinesterásicos: al inhibir la acción de esta
enzima, aumenta la cantidad de Ach disponible. Entre ellos tenemos:
-
Bromuro de piridostigmina (mestinón-180 mg).
- Neostigmina.
Dosis inicial en adultos:
30–60 mg cada 4–8 horas, vía oral (30-45 min antes de… ).
Dosis equivalente en Neostigmina (7.5–15.0 mg). (Disponible también en spray nasal o nebulizador).
Efectos adversos:
- Receptores muscarínicos: náuseas, vómitos, cólicos abdominales, diarrea, dificultad en la deglución, aumento se secreciones bronquiales y dificultad respiratoria.
- Receptores nicotínicos: incremento de la debilidad muscular.
- Bromismo: complicación rara con el uso del bromuro de piridostigmina que cursa con un estado de psicosis.
· Corticoesteroides (inmunosupresores esteroideos): en más del
75% de los casos tratados con Prednisona se consigue una gran mejoría o
remisión completa de los síntomas, el resto consigue al menos alivio. La mayor
parte de la mejoría se consigue a las 6-8 semanas, pero en los meses siguientes
puede recuperarse hasta llegar a ser total. Las mejores respuestas se presentan
en los pctes cuyos síntomas son recientes, pero incluso los que tienen
cronicidad de la enfermedad pueden mejorar. Se ha comprobado que la respuesta
más previsible a la prednisona es cuando el tratamiento empieza con una dosis
diaria de 1.5-2mg/kg. Esta dosis se mantiene hasta que se consigue una mejoría
estable, que habitualmente ocurre a las 2 primeras semanas, luego se va
reduciendo progresivamente durante varios meses hasta conseguir la dosis mínima
necesaria para mantener la mejoría, que normalmente es inferior a los 20mg/
días alternos. El ritmo de reducción se debe individualizar. El empeoramiento
es frecuente durante la primera semana con las dosis más altas o con los
incrementos más rápidos de éstas. Una vez que el efecto máximo se haya logrado
la dosis debe reducirse con lentitud durante meses hasta el punto más bajo en
el que aún es eficaz. El principal problema de los
corticoides son sus numerosos e importantes efectos secundarios: úlcera péptica,
diabetes, osteoporosis, hipertensión, cataratas, necrosis femoral, etc. Hay que
recomendar dietas con poca sal y abundantes en potasio y calcio, ejercicio
físico regular, y añadir medicaciones que prevengan la osteoporosis (alendronato más
calcio) y la úlcera (omeprazol o ranitidina).
· Inmunosupresores no esteroideos:
Azatioprina (Inmurán) (Tab. 50
mg): es de utilidad como coadyuvante o
auxiliar de los esteroides, en los que no toleran o no responden a la
prednisona, revierte los síntomas de muchos pacientes pero el efecto se retrasa 4-8
meses. La dosis inicial es de 50 mg al día, que se aumenta en incrementos de 50
mg por día hasta llegar a una dosis de 150 -200 mg al día. La función hepática
y el conteo de leucocitos deben vigilarse con regularidad. La mejoría se
mantiene mientras se administra el fármaco, pero los síntomas reaparecen si se
suspende el uso del mismo a los 2-3 meses. Los efectos adversos pueden ser: reacción
alérgica severa (rash, primeras 2 semanas), irritación gástrica (náuseas,
vómitos) leucopenia o pancitopenia, se debe realizar conteo hematológico
semanalmente el primer mes de tratamiento, mensualmente durante un año y
después cada 3-6 meses.
Si hay reducción de leucocitos es menor de 3500, se debe disminuir la dosis hasta que se obtenga una cifra mayor a
esta, pero si la reducción de leucocitos es menor
de 1000, se debe hacer una suspensión temporal del fármaco. El aumento de la TGP, si sobrepasa 2
veces el valor normal, obliga a suspender también, temporalmente, el medicamento.
Ciclosporina (Tab. 25 mg; A
Tab. 100 mg): reduce la proliferación de células T, aunque
es un fármaco ampliamente utilizado en los pacientes sometidos a trasplantes de
órganos, su uso en la miastenia está reducido a casos rebeldes a los demás
fármacos. Es el único inmunosupresor que ha demostrado ser beneficioso en
estudios clínicos. Dosis: 5-6 mg/kg/día, dividido en 2 dosis cada 12 horas. Seguimiento
mensual de ciclosporinemia (hasta 75-150 ng/ml) y creatinina (incremento menor
de 150% de valores pre-tratamiento). El comienzo de la mejoría clínica se aprecia en 1-2
meses, cuya respuesta máxima es en 6 meses o más. Su uso en la actualidad no es
frecuente debido a sus efectos colaterales graves como HTA y nefrotoxicidad además de su costo elevado.
Micofenolato
Mofetilo (Tab. 500 mg): Se utiliza como adyuvante de los Corticoesteroides y la
dosis habitual es de 2g al día, en dosis fraccionadas cada 12 horas,
habitualmente se aprecia la mejoría dentro de 2 semanas- 2 meses, el efecto
2rio más frecuente es la diarrea y leucopenia.
Ciclofosfamida (Tab. 50 mg): Dosis oral recomendada es de: 150-200 mg/día hasta un total de 5-10 gr. mientras la dosis IV de: 200 mg por día/5 días. Más de la mitad de los pacientes están asintomáticos después de un año del tratamiento. Reacciones adversas: alopecia, leucopenia, náuseas, vómitos, anorexia, decoloración de las uñas y la piel frecuente. Hay que vigilar con regularidad la función hepática y los leucocitos.
· Tratamiento inmunomodulador:
Plasmaféresis: tratamiento para uso en pacientes con empeoramiento repentino de los síntomas, preparación rápida para cirugía o respuesta deficiente a los tratamientos convencionales. Dosis: 3-6 sesiones (removiendo 3-5 litros de plasma en cada sesión).
La mejoría suele comenzar en 48 horas. La máxima mejoría puede alcanzarse después de la primera sesión o puede demorar 14 días. La mayoría de los pacientes que responden a la primeras Plasmaféresis responden a cursos sucesivos, pero sesiones repetidas no tienen beneficio acumulativo.
La plasmaféresis tiene una serie de ventajas como: produce rápida
mejoría, no tiene efectos crónicos secundarios conocidos, pero también tiene ciertas desventajas como: elevado costo,
requiere inmunosupresión concomitante, esteroides, o Timectomía para un
beneficio de larga duración.
Entre sus efectos adversos más comunes se describen: arritmias cardíacas transitorias
náuseas, oscurecimiento de la visión, edema pedal. Son infrecuentes: la trombosis, la tromboflebitis y la endocarditis bacteriana subaguda por los shunts, enfermedad
similar a la influenza en pacientes con niveles reducidos de inmunoglobulinas.
Infección sistémica grave por bacterias o citomegalovirus.
· Inmunoglobulina Intravenosa (Intacglobín): es un inmunomodulador de los anticuerpos anti-receptor de la acetilcolina y la introducción de anticuerpos anti-idiotipos. Tiene indicación en pacientes con empeoramiento repentino de los síntomas (descompensados), preparación para la Timectomía u otras cirugías (3 dosis antes y 2 dosis después de la misma) o crisis miasténica. También cuando se comienza el tratamiento con esteroides y el paciente tiene debilidad muscular intensa y en los pacientes que no responden a otras terapias. Ofrece solo beneficio a corto plazo.
Los reportes de la literatura informan una respuesta favorable a dosis de 400 mg/kg/día durante 3-5 días en infusión IV (pasar en 4-6 horas), existiendo mejoría en 50-100 % de los pacientes. El comienzo de esta mejoría es habitualmente en una semana y dura semanas o meses. Está contraindicada en pacientes con deficiencia de IGA (reacción anafiláctica). Sus efectos adversos más comunes son: cefalea, escalofríos y fiebre, es por ello que se debe administrar dipirona (600mg) 1 ámp. más difenhidramina 1 ámp. (IM) antes de la infusión. Otra alternativa es acetaminofén o dipirona más difenhidramina. Otros efectos adversos raros que pueden aparecer son: alopecia, meningitis aséptica, leucopenia, necrosis retiniana, hepatitis.
Tratamiento quirúrgico:
Timectomía: es recomendada para la mayoría de los pacientes con Miastenia gravis, excepto en la Miastenia ocular y se realiza solo de manera electiva. Se realiza tanto en pacientes que presentan timoma como restos tímicos. El mejor efecto se logra en pacientes jóvenes y al inicio de la enfermedad, habitualmente 2- 5 años posteriores a la misma, aunque la remisión total es rara. La mejoría es menos evidente en pacientes con timoma y comienzo de la enfermedad después de los 60 años. Las concentraciones de anticuerpo receptor circulante se reducen o desaparecen por completo. El procedimiento no tiene efectos secundarios crónicos conocidos y produce mejoría de larga duración, sin embargo, tiene como inconvenientes la comorbilidad y mortalidad operatoria.
Recientemente, en abril del 2022, ha sido aprobado por la FDA un nuevo fármaco, el Ravulizumab. Se trata de un anticuerpo monoclonal, inhibidor del complemento C5 de acción prolongada, que se emplea como tratamiento para adultos con Miastenia gravis generalizada y con anticuerpos positivos frente a receptores de acetilcolina, de forma complementaria al tratamiento convencional. Incluso ya ha sido autorizado también en Japón y la Unión Europea. Ha demostrado un beneficio clínico de duración de hasta 60 semanas. Se comercializa con el nombre de Ultomiris con presentaciones de 300 mg/3 ml, 1100 mg/11 ml y 300 mg/30 ml concentrado para solución para perfusión. Se administra según el peso corporal:
- 40 a 60 kg: dosis de carga de 2400 mg y de mantenimiento 3000 mg cada 8 semanas.
- 60 a 100 kg: dosis de carga de 2700 mg y de mantenimiento 3300 mg cada 8 semanas.
- Más de 100 kg: dosis de carga de 3000 mg y de mantenimiento 3600 mg cada 8 semanas.
Teniendo en cuenta que, independiente del peso, la primera dosis de mantenimiento se administra 2 semanas después de la dosis de carga.
Las reacciones adversas más comunes observadas han sido: diarreas, infecciones de vías respiratorias altas, nasofaringitis y cefalea.
En junio del presente año se ha dado a conocer, por la revista The Lancet Neurology, una nueva terapia que se encuentra en investigación. Es la terapia de células T con receptores quiméricos de antígenos (CAR-T) con linfocitos modificados que cuenta con algunos resultados preliminares muy prometedores.
Estos últimos avances resultan muy alentadores y vislumbran el camino hacia una potencial cura o al menos un excelente control de los síntomas de la enfermedad.



No hay comentarios.:
Publicar un comentario